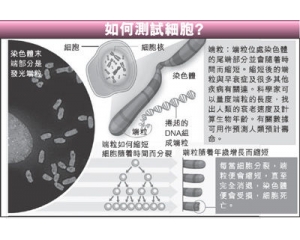
细胞标本的制备方法有印片法如下。穿刺涂片法、沉淀法及活细胞标本的制备等,现分述: 本文来自实验室前沿
(一)印片法
常用于手术切除标本。将新鲜标本沿病灶中心切开,将盖玻片压在病灶上,细胞即可附肝脾胰肾于载玻片。吹干或自然晾干后立即置于固定液内10~15min,取出后自然晾干,低温保存备用。
印片法操作简便,抗原保存好。缺点是有时细胞厚薄不均,并且载玻片上组织液较多,可能会影响标记结果。
(二)穿刺涂片法
常用于体表肿瘤以及肝、肾、肺、后腹膜肿瘤等穿刺。如穿刺液较少,可直接涂于载玻片,注意涂抹均匀;如穿刺液较多,细胞较丰富,可滴入装有1—2ml Hanks液(或RP—M11640液)的试管内,以500r/min低速离心10~15min,弃上清,吸取1—2滴沉淀物滴在载玻片上,镜下观察细胞排列较密而不重叠为宜,自然晾干后固定。
穿刺法操作简便,细胞形态保持较好,但细胞分布不均匀。
(三)沉淀法
主要用于尿液、胸腹水、脑脊液等体液多而细胞少的标本,其制备方法有二种。
1.常规制备法
根据标本内细胞量的多少用不同的方法。如果细胞较多,液体浑浊,可吸取1—2滴直接涂在载玻片上,并注意涂均匀;如果细胞较少,可吸取瓶底自然沉淀液5ml,1500~2000r/min离心10min后,倒掉上清液,吸取1—2滴沉淀涂在载玻片上。如有细胞离心涂片器,可将标本用上述离心法制成2X105个细胞/ml的细胞悬液,吸取50gl加入涂片器内,离心后即制成分布均匀的细胞玻片。细胞分布在直径6mm的小圈内,每个圆圈内的细胞数约10s个。
2.单核细胞分离法
主要用于周围血或胸腹水中淋巴细胞的免疫细胞化学标记,以鉴别B淋巴细胞性白血
病、T淋巴细胞性白血病或恶性淋巴瘤。如为血性胸腹水,标本经1500r/min离心10min后弃上清,在沉淀中加15ml RPMll640培养液,再用淋巴细胞分离液分离单核细胞。在5mlRPMll640培养液内于37℃培养30min后,离心沉淀,取上清,制成浓度为2X106个细胞/ml的细胞悬液,吸取50gl滴于载玻片上,略干,固定10min,取出晾干后备用。
3.注意事项
(1)在制备过程中,因反复离心洗涤后细胞黏附性较差,易脱片,因此载玻片应预先涂黏合剂。
(2)为节省试剂和便于观察,制片时细胞应集中在直径在o.6~1.0cm的圆圈内,细胞总数以105个为宜。
(3)富于黏液的标本,如痰液、食管拉网、胃液等,未经处理时不宜做免疫组化标记。
(四)活细胞标本的制备
活细胞标本一般用于单克隆抗体的筛选、细胞骨架蛋白的定位研究。标本来源主要是建株细胞、培养细胞、外周血等。细胞可直接培养在盖玻片上、培养瓶内或培养板上,也可将一定量的细胞收集离心进行涂片。不管任何形式,在进行免疫组化标记前均需反复洗涤,乙醇、丙酮或4%多聚甲醛固定。乙醇、丙酮固定5~15min,4%多聚甲醛固定3~5min。活细胞标本固定后应立即进行免疫组化定位。